目次
ICHとは
ICHとは、International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use(医薬品規制調和国際会議)の略称です。
ICHは、医薬品規制当局と製薬業界の代表者が協働して、医薬品規制に関するガイドラインを科学的・技術的な観点から作成する国際会議で、他に類がない場となっています。ICHは、1990年の創設以来、グローバル化する医薬品開発・規制・流通等に対応するべく、着実に進化を遂げてきました。ICHの使命は、限られた資源を有効に活用しつつ安全性・有効性及び品質の高い医薬品が確実に開発され上市されるよう、より広範な規制調和を世界的に目指すことです。
2015年10月23日、ICHはスイス法人化に伴い、組織再編をしました。その結果、現在のICHは、全ての参加メンバーで構成され法人の主体となる総会(Assembly)、総会での議論の準備や法人の運営を担う管理委員会(Management Committee)、専門家がガイドラインの議論を行う各作業部会(Working Group)等から成り立っています。
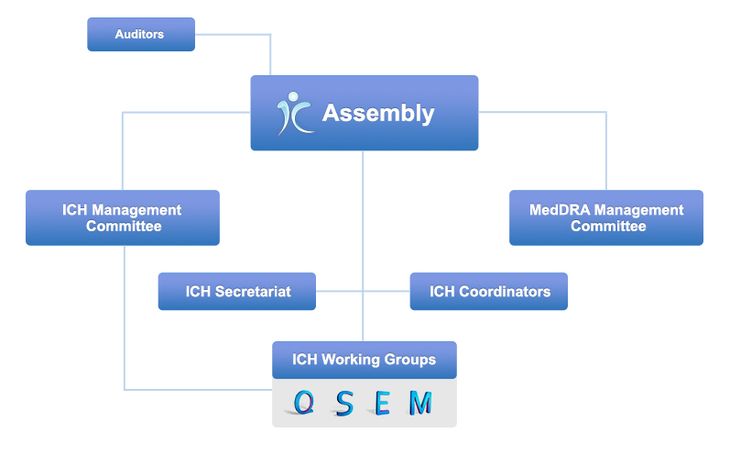
ICHの目的と役割
ICHの目的は、新医薬品を時宜に即し、また継続的に患者が利用できるようにすること、ヒトにおける不必要な臨床試験の重複を避けること、安全性、有効性及び品質の高い医薬品が効率的に開発、登録及び製造されること、及び安全性及び有効性が損なわれることなく動物試験が軽減されることに資する技術的要件における国際調和を促進することで公衆衛生を促進することです。
PMDAは、日本の医薬品規制当局代表の一員として参加しています。薬学・医学・獣医学・理学・生物統計学等の専門性を有するPMDA職員が、ICHの専門家作業部会に参加し、ガイドラインの作成・改訂を行うとともに、ICHでの合意形成に関わっています。
※ガイドラインの合意(調和)までのプロセスはこちらのページをご覧ください。
ICH発足の経緯
日本・米国・ヨーロッパでは、医薬品の販売開始前に政府による評価・承認を行うため、それぞれ独自に法制度を整備してきました。特に1960年代から1970年代にかけては、各国で急速に法令やガイドラインが整備され、新医薬品の品質、有効性および安全性についてのデータ報告・評価の体制が整いました。しかし、新医薬品の品質、有効性、安全性を評価するという基本は共通であったものの、承認申請の際の詳細な技術的要件は地域により異なっていました。製薬企業の国際化に伴い、各地域の規制要件を満たすため、時間とコストのかかる重複した試験を数多く行う必要がありました。
そのため、拡大する医薬品開発コストへの懸念を背景に、必要な患者に安全で有効な新医薬品をより早く提供するため、各地域の医薬品承認審査の基準の合理化・標準化が必要となり、1990年4月、日本・米国・ヨーロッパの各医薬品規制当局と業界団体の6者によりICHが発足しました。
ICHは発足以降、毎年2回会合を続けています。また、ICH会合後、各地域でICHの公開シンポジウムが開催されています。
新医薬品の品質・有効性・安全性の評価にかかわる技術的なガイドラインだけでなく、最近では承認申請資料の形式、市販後安全体制などの調和も進めており、またICHに参加していない国・地域との交流、情報の共有化が進んでいます。
参照
https://www.pmda.go.jp/int-activities/int-harmony/ich/0014.html
