Table of Contents
はじめに
近年、個人のゲノム情報に基づき、個々人の体質や病状に適した、より効果的・効率的な疾患の診断、治療、予防が可能となるゲノム医療への期待が高まっている。また、諸外国では、国家プロジェクトとして、ゲノム医療や研究の取組が進められている。米国では、2015 年より Precision Medicine Initiative を開始し、遺伝子等に関する個人毎の違いを考慮した予防や治療法を確立する等の取組が推進されている。英国では、2018 年に Genomics England が、がんや稀少疾患を対象に、10 万ゲノム解析を完了し、2023 年までに 100 万の全ゲノム解析等の実施を目指している。
我が国では、2015 年に健康・医療戦略推進本部にゲノム医療実現推進協議会が設置され、ゲノム医療の社会実装に向けた検討が行われている。その中でゲノム情報等と疾患に関し、比較的エビデンスが蓄積されており、医療への実利用に近い疾患・領域(がん・難病(厚生労働省))、医療への実利用には長い時間を要するが、多くの国民が罹患する一般的な疾患・領域(糖尿病、循環器疾患等(文部科学省))、疾患のゲノム情報等を比較対象として用いるコントロール群(文部科学省)といった分野毎に、ゲノム研究が進められている。
また、がん領域では、がんゲノム医療推進コンソーシアム運営会議を開催し、がんゲノム医療の推進に向けた体制整備が進められている。また、2019 年6月には、遺伝子パネル検査が保険適用され、国民皆保険の下での検査が実施されている。難病領域では、難病法に基づく医療提供体制の構築にあたって遺伝学的検査の充実を図るとともに、未診断疾患イニシアチブ(Initiative on Rare and Undiagnosed Disease(IRUD))やオミックス解析拠点において、希少難治性疾患等のゲノム解析研究等が実施されている。
また、「経済財政運営と改革の基本方針 2019」(令和元年6月 21 日閣議決定)において、全ゲノム解析等に関して、「ゲノム情報が国内に蓄積する仕組みを整備し、がんの克服を目指した全ゲノム解析等を活用するがんの創薬・個別化医療、全ゲノム解析等による難病の早期診断に向けた研究等を着実に推進するため、10 万人の全ゲノム検査を実施し今後 100 万人の検査を目指す英国等を参考にしつつ、これまでの取組と課題を整理した上で、数値目標や人材育成・体制整備を含めた具体的な実行計画を、2019 年中を目途に策定する」こととされた。
析等(全エクソーム解析・トランスクリプトーム解析を含む)を推進するため、がんや難病領域の「全ゲノム解析等実行計画」を策定する。
「全ゲノム解析等実行計画」の策定にあたっては、厚生労働省内に、医務技監を本部長とする「全ゲノム医療推進チーム」を設置し、検討を行うとともに、がんと難病領域について、有識者からなる検討の場を開催し、議論を行ってきた。がん領域については、「がんゲノム医療推進コンソーシアム運営会議」の下に、「がんに関する全ゲノム解析等の推進に関する部会」を設け、議論を行った。難病領域については、「難病に関するゲノム医療の推進に関する検討会」を開催、議論を行った。その後、がんと難病領域について、厚生科学審議会科学技術部会に報告を行った。
【がんに関する全ゲノム解析等の推進に関する部会】
第1回 10 月 16 日
第2回 11 月 20 日
第3回 12 月3日
【難病に関するゲノム医療の推進に関する検討会】
第1回 10 月8日
第2回 11 月 19 日
第3回 12 月3日
1.これまでの取組と課題の整理
我が国のゲノム解析研究は、文部科学省や厚生労働省の研究事業として、国内の様々な研究グループによって実施されている。
主なゲノム解析研究としては、東京大学等によるオーダーメイド医療の実現プログラム及びゲノム研究バイオバンク事業(バイオバンク・ジャパン)では、がんや糖尿病、循環器疾患等延べ約 3500 検体の全ゲノム解析等を実施している。また、国立国際医療センター等による臨床ゲノム情報統合データベース整備事業では、難病や認知症等約 2000 検体の全ゲノム解析等を、がんや難病等 1.9万検体の全エクソーム解析を実施している。
さらに、東北大学等による東北メディカル・メガバンク計画では、健常人(日本人一般集団)約 8000 検体の全ゲノム解析等を実施している。
これまでのゲノム解析研究は、がんや難病の本態解明や効果的な診断治療法などの研究開発の促進に確実に貢献してきたと考えられる一方で、全ゲノム解析等の対象が一部のがんや難病に限定されており、大規模な日本人の全ゲノム配列データベースが構築されていないこと、また、アカデミアや民間企業を対象としたデータ二次利活用が進んでおらず、創薬等の産業利用が進んでいないこと等が課題として指摘されている。
こうした状況を踏まえ、今般、我が国においても、国家戦略として、一人ひとりにおける治療精度を格段に向上させ、治療法のない患者に新たな治療を提供するといったがんや難病等の医療の発展や、個別化医療の推進などを目的として、全ゲノム解析等を推進するため、がんや難病領域の「全ゲノム解析等実行計画」を策定することとした。
2.全ゲノム解析等の必要性・目的
2.1 がん領域
がんの全ゲノム解析等は、一人ひとりにおける治療精度を格段に向上させ、治療法のない患者に新たな治療を提供するといったがん医療の発展や個別化医療の推進など、がんの克服を目指したがん患者のより良い医療の推進のために実施する。全ゲノム解析等により、がん医療への活用、日本人のがん全ゲノムデータベースの構築、がんの本態解明、創薬等の産業利用を進めていく。
(がん医療への活用)
日本人の各種のがんについて、質の高い臨床情報とともに、全ゲノム情報等を収集・解析することで、より効果的な予防、診断、治療法などの開発を促進し、個別化医療を推進する。短期的には、現在は研究段階であるリキッドバイオプシーによる層別化医療や再発予測、ゲノム情報に基づく医薬品の使い分けなどの個別化医療を推進し、ネオアンチゲンや特異的TCR導入T細胞療法等といった新たな治療法を開発する。また、オミックス解析を同時に実施することにより我が国の医薬品に関する研究開発を促進し、将来的には、がん患者の生殖細胞系列の解析結果をもとに、リキッドバイオプシーによるがんの早期発見やがんを予測する技術、ヘルスケア分野へ活用する。これらの成果によって、我が国におけるがん医療を、より高精度かつ効率的な段階に移行させる。
(日本人のがん全ゲノム配列データベースの構築)
日本人のがん患者の全ゲノム情報等を網羅的に収集し、質の高い臨床情報を統合したがんの全ゲノム配列データベースを作成する。このデータベースは、日本人のがん患者に対するゲノム医療の基盤となるほか、国のがん対策に活用する。また、日本人のがんの全ゲノム配列データベースは、海外先行事例との差別化が必要である。
(がんの本態解明)
全ゲノム解析等を実施することによって、遺伝子パネル検査や全エクソーム解析では得ることができないがんゲノム情報の収集を可能とし、がんの本態解明をさらに進める。
(創薬等の産業利用)
新たながん化メカニズムや薬剤耐性機序の解明を加速し、創薬のターゲット探索空間を大幅に広げる。また、日本人に多いがんを対象として、遺伝子パネル検査の開発、改良など、診断薬についても進歩させる。
2.2 難病領域
難病の全ゲノム解析等は、難病の早期診断、新たな治療法開発など、難病患者のより良い医療の推進のために実施する。全ゲノム解析等により、難病の本態解明、効果的な治療・診断方法の開発促進を進めていく。
(難病の本態解明)
全ゲノム解析等を実施することによって、イントロンや調節領域、さらには、ゲノム構造など遺伝子パネル検査や全エクソーム解析では得ることができない情報の集積が可能となる。
これにより、難病の本態解明が進み、客観的な診断基準の確立・改善に資する知見を得、難病の早期診断につなげる。
(効果的な治療・診断方法の開発促進)
難病の質の高い臨床情報とともにゲノム情報を収集・解析することで、本態解明に加え、難病患者を対象とした、より効果的な治療・診断方法の開発を促進する。
3.具体的な進め方
3.1 がん領域
全ゲノム解析等を進めつつ、得られた成果を、遺伝子パネル検査やリキッドバイオプシー等に導出し、患者の層別化医療につなげるなど、速やかに医療現場の実利用に生かしていく。また、今後提供される新たな検体について、全ゲノム解析等により得られた成果も、提供した患者の医療に適切に活用する。
がんの全ゲノム解析等を進めるにあたり、まず、先行解析で日本人のゲノム変異の特性を明らかにし、本格解析の方針決定と体制整備を進める。このため、最大3年程度を目処に当面は、主要なバイオバンクの検体(現在保存されている最大約 6.4 万症例(13 万ゲノム))及び今後提供される新たな検体数αを解析対象とする。
先行解析では、そのうち、当面は、解析結果の利用等に係る患者同意の取得の有無、保管検体が解析に十分な品質なのか、臨床情報の有無等の条件を満たして研究利用が可能なものを抽出した上で、有識者会議での意見を踏まえ、5年生存率が相対的に低い難治性のがんや稀な遺伝子変化が原因となることが多い希少がん(小児がんを含む)、遺伝性のがん(小児がんを含む)について、現行の人材・設備等で解析が可能な範囲で全ゲノム解析等を行う。
先行解析の症例数:
現在保存されている約 1.6 万症例(3.3 万ゲノム)及び今後提供される新たな検体数β)
先行解析では、日本人の全ゲノム解析等により諸外国のデータベースとゲノム変異の違いを確認し、ゲノム変異の違いを明らかにしつつ、本格解析の対象となるがん種やその数値目標に関する方針や、統一された規格のもとでの全ゲノム情報等及び臨床情報の収集方法、検体処理等のワークフロー、専門家の人材育成、ELSI(倫理的・法的・社会的な課題)に対応する体制の在り方等の体制整備・人材育成の検討を進める。その際、医薬品の開発を通じて患者に還元するための産業利用も含めたインフォームドコンセントの在り方を検討する。
先行解析後の本格解析では、先行解析の結果や国内外の研究動向等を踏まえ、新たな診断・治療等の研究開発が期待される場合等に数値目標を明確にして、新規検体を収集して実施する(数値目標を先行解析中に明らかにできた場合には本格解析に切り替える)。数値目標は、必要に応じて随時見直していく。
がん全ゲノム解析等の数値目標
| がん種 | 必要な検体の種類 | 先行解析 | 本格解析 | |
| 解析対象の最大症例数 | 先行解析の症例数 | |||
| 罹患数の多いがん・難治性がん | がん部位(新鮮凍結検体)+血液(正常検体) | 約5.6万症例(11.2万ゲノム)+α | 難治性のがん、希少がん、遺伝性のがんの約1.6万症例(3.3万ゲノム)+β | 先行解析の結果や国内外の研究動向等を踏まえて検討 |
| 希少がん(小児がんを含む) | 約0.7万症例(1.4万ゲノム)+α | |||
| 遺伝性のがん(小児がんを含む) | がん部位(新鮮凍結検体)+血液(正常検体) (必要に応じて両親や同胞の正常検体) |
約0.2万症例(0.4万ゲノム)+α (必要に応じて両親や同胞の正常検体0.19万ゲノム) |
||
| 合計 | 約6.4万症例(約13万ゲノム)+α | - | - | |
3.2 難病領域
難病の全ゲノム解析等を進めるにあたり、まず、先行解析で本格解析の方針決定と体制整備を進める。このため、最大3年程度を目処に当面は、主要な解析拠点の検体(現在保存されている最大約 2.8 万症例(約 3.6 万ゲノム))及び今後提供される新たな検体数αを解析対象とする。
先行解析では、そのうち、当面は、解析結果の利用等に係る患者同意の取得の有無、保管検体が解析に十分な品質なのか、臨床情報の有無等の条件を満たして研究利用が可能なものを抽出した上で、有識者会議での議論を踏まえ、単一遺伝子性疾患、多因子性疾患、診断困難な疾患に分類し、成果が期待できる疾患について、現行の人材・設備等で解析が可能な範囲で全ゲノム解析等を行う。
(先
行解析の症例数:現在保存されている約 5500 症例(6500 ゲノム)及び今後提供される新たな検体数β)
先行解析では、本格解析の対象となる疾病やその数値目標に関する方針や、統一された規格のもとでの全ゲノム情報等及び臨床情報の収集方法、検体処理等のワークフロー、専門家の人材育成、ELSI(倫理的・法的・社会的な課題)に対応する体制の在り方等の体制整備・人材育成の検討を進める。
全ゲノム解析等を進めつつ、得られた成果を、遺伝子パネル検査等に導出し、患者の層別化医療につなげるなど、速やかに医療現場の実利用に生かしていく。また、今後提供される新たな検体について、全ゲノム解析等により得られた成果も、提供した患者の医療に適切に活用する。
先行解析後の本格解析では、先行解析の結果や国内外の研究動向等を踏まえ、新たな診断・治療等の研究開発が期待される場合等に数値目標を明確にして、新規検体を収集して実施(数値目標を先行解析中に明らかにできた場合には本格解析に切り替える)する。数値目標は、必要に応じて随時見直していく。
難病全ゲノム解析等の数値目標
| 対象類型 | 必要な検体の種類 | 先行解析 | 本格解析 | |
| 解析対象の最大症例数 | 先行解析の症例数 | |||
| 単一遺伝子疾患(筋ジストロフィー等) | 血液(加えて両親の血液) | 約0.1万症例(約0.3万ゲノム)+α | 単一遺伝子疾患、多因子疾患、診断困難な疾患の約5500症例(6500ゲノム)+β | 先行解析の結果や国内外の研究動向等を踏まえて検討 |
| 多因子疾患(パーキンソン病等) | 血液 | 約2.4万症例(約2.4万ゲノム)+α | ||
| 診断困難な疾患 | 血液(加えて両親の血液) | 約0.3万症例(約0.9万ゲノム)+α | ||
| 合計 | 約2.8万症例(約3.6万ゲノム)+α | - | - | |
がん・難病全ゲノム解析等の工程表
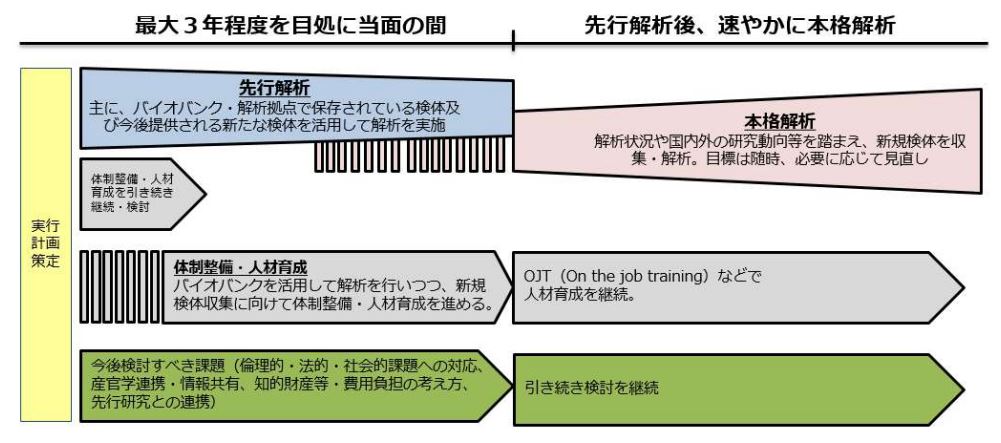
4.体制整備・人材育成
先行解析では、臨床情報の収集方法、検体処理等のワークフロー、専門家の育成、ELSI(倫理的・法的・社会的な課題)に対応する体制の在り方等を検討した上で、体制整備・人材育成を進める。
体制整備を検討するにあたっては、データ等の収集、管理・運営、利活用の各段階の課題を整理していく。データ等の収集段階では、臨床情報の収集方法、検体処理等のワークフロー等について検討を進める。データ等の管理・運営段階では、シークエンスを担う機関、データ等の管理・運営主体の在り方等について検討を進める。データ等の利活用の段階では、当初から産業利用も視野に入れたデータ利活用体制の構築、費用負担(民間資金の活用)等について検討を進める。人材育成を検討するにあたっては、医師、遺伝カウンセラー、バイオインフォマティシャン・遺伝統計学者、コーディネーター、倫理の専門家、その他医療従事者等の全ゲノム解析等に必要な人材について検討を進める。
先行解析後の本格解析では、先行解析で整備された体制の下で解析を実施しつつ、厚生労働省と関係機関で連携しながら全ゲノム解析等に必要な知識や技術についてOJT(On the Job Training)等を活用した人材育成を継続する。
5.今後検討すべき事項
(ELSI(倫理的・法的・社会的な課題)への対応)
全ゲノム解析等を推進するにあたり、患者・市民参画の仕組みを設けるなどELSI(倫理的・法的・社会的な課題)への対応ができる体制の在り方等について検討する。全ゲノム解析等は、膨大な2次的所見が発見されることが想定されるため、どのような情報を返すべきか検討を行った上で患者や家族への丁寧な説明が必須となる。全ゲノム解析等を推進するにあたり、「ヒトゲノム・遺伝子解析研究に関する倫理指針」等の運用を確認しつつ、全ゲノム解析等の結果により、社会の様々な場面で不適切な取扱いを受けたり、不利益を被ったりすることがないよう、相談支援体制の確保やゲノム研究及び医療に関する知識の普及・啓発など社会環境の整備が重要である。そのための必要な方策について引き続き検討する。
(産学連携体制・情報共有体制の構築)
がん患者のより良い医療の推進や全ゲノム解析等を効率的に推進するため、産学双方に利益のある体制を構築することを目指し、産学連携体制・情報共有体制の構築を検討する。また、医薬品の開発を通じて患者に還元するため、当初から資金を拠出した民間企業のデータ等の利活用を優先する制度構築等、産業利用も視野に入れたデータ利活用体制の構築等について検討を進める。
(知的財産等の考え方)
全ゲノム解析等の過程で発見された新たな知見や一定の症例を集積した結果得られた知見の取扱いに関する適切なルールの策定を検討する。
(費用負担の考え方)
全ゲノム解析等に係る費用負担(民間資金の活用)の考え方について、体制整備の検討とあわせて整理し、本格解析の実施時に実行できるよう関係者と検討を進める。
(先行研究との連携)
全ゲノム解析等を推進するにあたっては、先行している遺伝性のがんや難病等の研究対照群(コントロール群)の全ゲノム解析等と合わせて、総合的に大きな成果を得られるよう取り組んでいく。そのために必要な方策について引き続き検討する。
(用語の定義)
<ゲノム>
遺伝子(gene)と染色体(chromosome)から合成された言葉で、DNA の全ての遺伝情報のこと。
<ゲノム医療>
個人のゲノム情報をはじめとした各種オミックス検査情報をもとにして、その人の体質や病状に適した医療を行うことをいう。
<遺伝子パネル検査>
遺伝子変異を一度に数十から数百解析し、抗がん剤等の治療薬の選択に役立てる検査をいう。
<全ゲノム解析>
全ゲノムの塩基配列を網羅的に解析する手法。
<全エクソーム解析>
全ゲノムのうち、エクソン領域(主にタンパク質をコードする領域)を網羅的に解析する手法。
<トランスクリプトーム解析>
細胞内における遺伝子転写産物(mRNA)全てを要素とする集合を解析するものをいう。
<リキッドバイオプシー>
血漿(けっしょう)や尿、唾液などの体液に含まれる遺伝子を解析することをいう。
<ネオアンチゲン>
遺伝子変異によってがん細胞に特異的に産出される、がん特異的な免疫を誘導するペプチドのことをいう。
<特異的TCR導入T細胞療法>
がん抗原特異的キラーT細胞クローンから得られたがん抗原特異的TCR遺伝子を患者末梢血由来リンパ球に遺伝子導入し輸注する治療法のことをいう。
<難病>
難病法上、医療費助成の対象となる指定難病(「発病機構が不明、治療方法未確立、希少疾病、長期療養が必要、客観的な診断基準が確立している」の5つの要件を満たすもの)は 333 疾病と多岐にわたる。これらの疾病は、遺伝学的な観点からは「単一遺伝子性疾患のみ」で構成されるもの、「単一遺伝性疾患と多因子疾患の混在」で構成されるもの、「多因子性疾患のみ」で構成されるものに類型化できる。また、指定難病に指定されていない疾患のうち、現時点で疾患概念が十分に確立していない疾患も本実行計画では広義の難病に含める。
<単一遺伝子性疾患>
単一の遺伝子の変異により起こる遺伝性疾患。
<多因子性疾患>
複数の遺伝子因子に加え、環境・生活習慣や老化が関わって発症する疾患。
<遺伝子多型>
ゲノム配列の個体差であり、ある塩基が他の塩基に置き換わっている配列の違い。
<オミックス解析>
生体中に存在する遺伝子(ゲノム)、蛋白質(プロテオーム)、代謝産物(メタボローム)、転写産物(トランスクリプトーム)等の網羅的な解析をする手法。
