Table of Contents
ガイドラインの目的
本ガイドラインは、承認申請のために規制当局に提出される適切に構成されたコモン・テクニカル・ドキュメント(CTD)の作成について、合意に達した共通の様式を示したものである。申請資料作成のための共通様式は、医薬品承認申請のための文書編集に要する時間及び資源を著しく軽減し、電子申請の準備を容易にするであろう。また、規制当局による審査及び申請者とのコミュニケーションは、共通の構成要素から成る標準化された文書により促進されるであろう。さらに、規制当局間の規制情報の交換を容易にするであろう。
背景
ICH(日米EU医薬品規制調和国際会議)により、医薬品の承認申請のための技術的要件については、三地域間で相当の調和が達成されてきた。しかしながら、現在まで承認申請文書の構成に関する調和が達成されてきていなかった。各地域は、提出書類中の申請資料の配列並びにサマリー及び表作成のためのそれぞれの要件を有している。日本では、申請者は、承認申請資料をまとめた資料概要を作成しなければならない。欧州では、エキスパート・レポート(Expert Report)及び概要表(Tabulated Summary)が要求され、概要文(Written Summary)を提出することが推奨されている。米国FDAには、新薬承認申請の様式及び内容に関するガイダンスがある。地域間で異なった承認申請資料の作成・編集の必要性を避けるため、本ガイドラインでは、三地域のいずれにおいても受入れ可能なCTDのための様式を提示する。
本ガイドラインの適用範囲
本ガイドラインは、主に新有効成分含有医薬品(バイオテクノロジー応用医薬品を含む。)の承認申請において示されるべき資料の構成について述べたものである。
本ガイドラインは、どのような試験の実施が要求されるのかを示すことを意図したものではなく、単に得られたデータに用いられる適切な様式を示しているに過ぎない。申請者は、本ガイドラインに示されているCTD全体の構成を変更すべきではないが、非臨床及び臨床概要においては、試験成績の理解及び評価を容易にするために、必要に応じ、申請資料の内容が可能なかぎり最も適切な表記となるよう、個々の資料の様式を変更することは差し支えない。
一般原則
基礎的データの審査を容易にし、審査官が申請内容を速やかに把握できるよう、資料内容の表現の仕方はCTD全体を通じてあいまいさを排し、わかりやすいものとすること。
本文及び表は、その内容がA4サイズ(EU及び日本)並びに8.5×11インチ(米国)の紙のいずれにも印刷できるだけの余白をもって作成すること。左側の余白を十分広くとり、綴じても情報が隠れないようにすること。本文及び表のフォントサイズは、複写後も十分に読みやすい大きさのスタイルと大きさとすること。本文の説明の記述には、英文の場合はTimes New Romanの12ポイント(注:日本語の場合はMS明朝の10.5ポイントに相当。)を推奨すること。全ページにページ番号をつけること。
各々のモジュールの中で用いられる頭文字及び略語は最初に定義すべきであること。
参考文献は「生物医学雑誌への投稿のための統一規定: Uniform Requirements for Manuscripts Submitted to Biomedical Journals, International Committee of Medical Journal Editors (ICMJE)」の最新版に従って引用されるべきであること。
CTDの構成
CTDは5つの部(モジュール)で構成されている。第1部(モジュール1)については各地域に特異的な部分である。第2部から第5部まで(モジュール2から5まで)は、全ての地域への申請において共通となるよう意図されている。本ガイドラインに従うことにより、これら4つの部(モジュール)は規制当局に対して受入れ可能な様式で提供されることとなる。
ICHコモン・テクニカル・ドキュメント構成の概念図
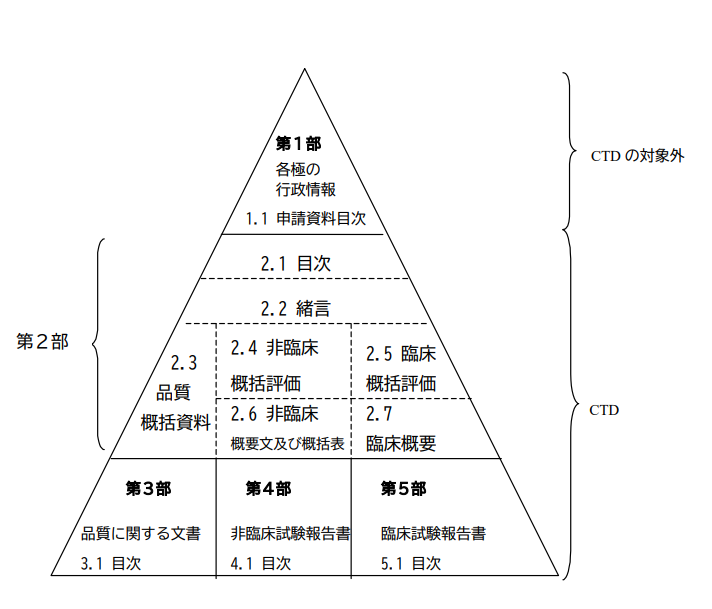
第1部(モジュール1) 申請書等行政情報及び添付文書に関する情報
この部(モジュール)には、例えば、当該地域における申請書又は添付文書(案)といった各地域に特異的な文書が含まれる。この部(モジュール)の内容及び様式については、当該規制当局が定めることができる。
第2部(モジュール2) CTDの概要(サマリー)
第2部(モジュール2)は、薬理学的分類、作用機序及び申請する効能又は効果等の当該医薬品の全般的な概略から始めること。原則として、この緒言は1ページ以内にまとめること。
第2部(モジュール2)は、以下の順番で7項目を含むこと:
- 目次
- 緒言
- 品質に関する概括資料
- 非臨床に関する概括評価
- 臨床に関する概括評価
- 非臨床試験に関する概要文及び概要表
- 臨床概要
これら概要の個々の構成については、CTD-品質に関する文書の作成要領に関するガイドライン(M4Q)、CTD-非臨床に関する文書の作成要領に関するガイドライン(M4S)、及びCTD-臨床に関する文書の作成要領に関するガイドライン(M4E)のそれぞれのガイドライン中に規定するものである。
第3部(モジュール3) 品質に関する文書
品質に関する資料を、CTD-品質に関する文書の作成要領に関するガイドライン(M4Q)に記載された様式で添付すること。
第4部(モジュール4) 非臨床試験報告書
非臨床試験報告書を、CTD-非臨床に関する文書の作成要領に関するガイドライン(M4S)に記載された順序で添付すること。
第5部(モジュール5) 臨床試験報告書
臨床試験報告書及び関連資料を、CTD-臨床に関する文書の作成要領に関するガイドライン(M4E)に記載された順序で添付すること。
医薬品の承認申請のための国際共通化資料(コモン・テクニカル・ドキュメント)(CTD)の詳細な構成
第1部(モジュール1):申請書等行政情報及び添付文書に関する情報
- 1.1 第1部(モジュール1)を含む申請資料の目次
- 1.2 各地域に特異的な文書(申請書、添付文書(案)など)
第2部(モジュール2):CTDの概要(サマリー)
- 2.1 CTDの目次(第2部から第5部)
- 2.2 緒言
- 2.3 品質に関する概括資料
- 2.4 非臨床に関する概括評価
- 2.5 臨床に関する概括評価
- 2.6 非臨床試験の概要文及び概要表
- 薬理
- 薬物動態
- 毒性
- 2.7 臨床概要
- 生物薬剤学試験及び関連する分析法
- 臨床薬理試験
- 臨床的有効性
- 臨床的安全性
- 参考文献
- 個々の試験のまとめ
第3部(モジュール3):品質に関する文書
- 3.1 第3部(モジュール3)目次
- 3.2 データ又は報告書
- 3.3 参考文献
第4部(モジュール4):非臨床試験報告書
- 4.1 第4部(モジュール4)目次
- 4.2 試験報告書
- 4.3 参考文献
第5部(モジュール5):臨床試験報告書
- 5.1 第5部(モジュール5)目次
- 5.2 全臨床試験一覧表
- 5.3 臨床試験報告書
- 5.4 参考文献
参照
https://www.pmda.go.jp/int-activities/int-harmony/ich/0035.html
