人を対象とする生命科学・医学系研究に関する倫理指針見直しの方向性について(取りまとめ)
生命科学・医学系研究等における個人情報の取扱い等に関する合同会議
令和4年9月26日(月)
1.R3改正個情法を踏まえた指針のあり方に係る論点
(1)地方公共団体に関する全国的な共通ルールの規定
| <個情法との関係の整理>
デジタル社会の形成を図るための関係法律の整備に関する法律(令和3年法律第37号)の一部施行の予定に伴い、地方公共団体の個人情報保護制度について、従来は個別の条例で規律されていたものを、統合後の法に基づく全国共通ルールとして、行政機関及び独立行政法人等に対して本年4月より適用されているものと同様の規律を適用し、地方公共団体に対する規律についても、解釈運用・監視監督を委員会が一元的に担う仕組みを整備することとされた(令和5年4月1日施行予定)。
<現行指針における取扱い>
- 人を対象とする生命科学・医学系研究が実施される 地方公共団体の機関(議会を除く。以下同じ。)及び地方独立行政法人 についても「研究機関」に含まれ(指針第2⑾ のガイダンス 参照 )、指針の適用対象となる。
- もっとも、インフォームド・コンセントを受ける手続等(以下「 IC 手続」という。)に関しては、個人情報保護法(以下「個情法」という。)上の規律が民間部門と公的部門で異なっており、指針においては主に民間部門の規律 について言及している。公的部門の規律については、この指針の他に個情法第5章、ガイドラインや条例等を参照する必要 がある(指針第8の1のガイダンス 参照 )。
|
≪論点≫
- 上記の個情法改正を踏まえ、地方公共団体の機関及び地方独立行政法人について、指針においてどのような規定を置くべきか。
【方向性】
- 下記業務における個人情報、仮名加工情報又は個人関連情報の取扱いについては、原則として民間部門の規律が適用され(次ページ参照)、基本的に指針の対象は下記業務のいずれかに該当することから、現行の指針を踏襲するべき。
- 地方公共団体の機関 が行う、病院、診療所、及び大学の運営の業務
- 地方独立行政法人のうち 、試験研究等を主たる目的とするもの、大学等の設置・管理及び病院事業の経営を目的とするもの が行う業務
- 上記以外の公的部門の規律のみが適用される地方公共団体の機関・地方独立行政法人について、個情法、ガイドラインや条例等を参照する旨を記載するべき。
|
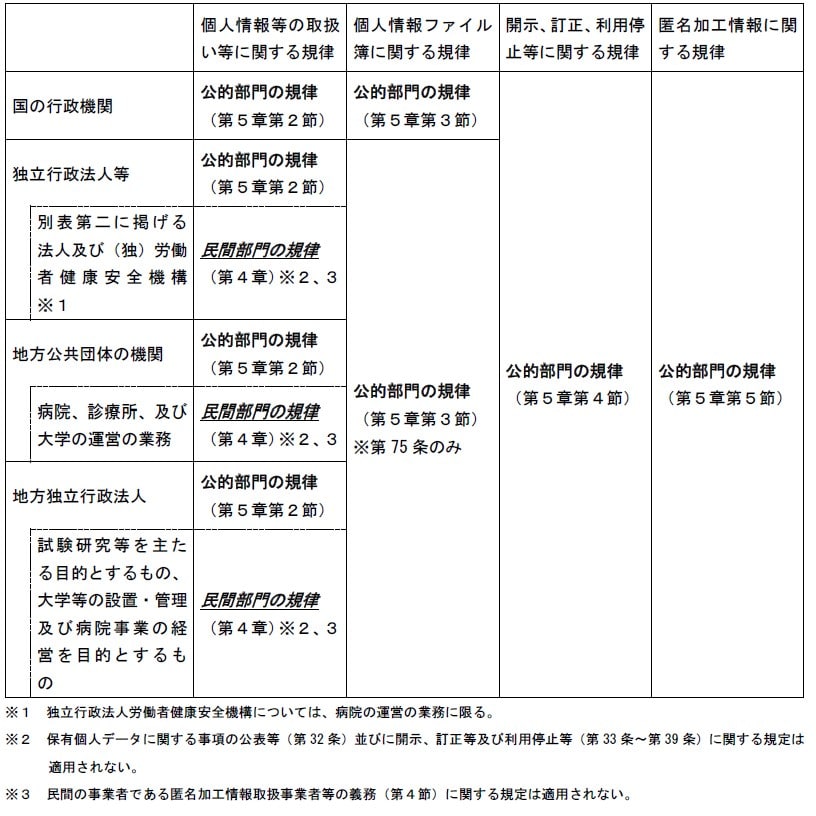
[参考]公的部門の機関、法人等の種別と規律の適用関係
第2回生命科学・医学系研究等における個人情報の取扱い等に関する合同会議 資料1(個人情報保護員会事務局説明資料)
[参考]関連規定
個情法第2条第11項
この法律において「行政機関等」とは、次に掲げる機関をいう。
一 行政機関
二 地方公共団体の機関(議会を除く。次章、第三章及び第六十九条第二項第三号を除き、以下同じ。)
三 独立行政法人等(別表第二に掲げる法人を除く。第十六条第二項第三号、第六十三条、第七十八条第一項第七号イ及びロ、第八十九条第四項から第六項まで、第百十九条第五項から第七項まで並びに第百二十五条第二項において同じ。)
四 地方独立行政法人(地方独立行政法人法第二十一条第一号に掲げる業務を主たる目的とするもの又は同条第二号若しくは第三号(チに係る部分に限る。)に掲げる業務を目的とするものを除く。第十六条第二項第四号、第六十三条、第七十八条第一項第七号イ及びロ、第八十九条第七項から第九項まで、第百十九条第八項から第十項まで並びに第百二十五条第二項において同じ。) |
個情法第58条
1 個人情報取扱事業者又は匿名加工情報取扱事業者のうち次に掲げる者については、第三十二条から第三十九条まで及び第四節の規定は、適用しない。
一 別表第二に掲げる法人
二 地方独立行政法人のうち地方独立行政法人法第二十一条第一号に掲げる業務を主たる目的とするもの又は同条第二号若しくは第三号(チに係る部分に限る。)に掲げる業務を目的とするもの
2 次の各号に掲げる者が行う当該各号に定める業務における個人情報、仮名加工情報又は個人関連情報の取扱いについては、個人情報取扱事業者、仮名加工情報取扱事業者又は個人関連情報取扱事業者による個人情報、仮名加工情報又は個人関連情報の取扱いとみなして、この章(第三十二条から第三十九条まで及び第四節を除く。)及び第六章から第八章までの規定を適用する。
一 地方公共団体の機関 医療法(昭和二十三年法律第二百五号)第一条の五第一項に規定する病院(次号において「病院」という。)及び同条第二項に規定する診療所並びに学校教育法(昭和二十二年法律第二十六号)第一条に規定する大学の運営
二 独立行政法人労働者健康安全機構 病院の運営 |
地方独立行政法人法第21条
地方独立行政法人は、次に掲げる業務のうち定款で定めるものを行う。
一 試験研究を行うこと及び当該試験研究の成果を活用する事業であって政令で定めるもの又は当該試験研究の成果の活用を促進する事業であって政令で定めるものを実施する者に対し、出資を行うこと。
二 大学又は大学及び高等専門学校の設置及び管理を行うこと並びに当該大学又は大学及び高等専門学校における技術に関する研究の成果の活用を促進する事業であって政令で定めるものを実施する者に対し、出資を行うこと。
三 主として事業の経費を当該事業の経営に伴う収入をもって充てる事業で、次に掲げるものを経営すること。
イ~ト (略)
チ 病院事業
リ (略) |
2.インフォームド・コンセントのあり方に係る論点
(1)仮名加工情報の利用に係るインフォームド・コンセント手続
<現行指針における取扱い>
- 仮名加工情報を 研究に用いる 場合、 当該情報は 基本的には個人情報に該当することから、既に 仮名加工情報として 作成されているものに限 り インフォームド・コンセント(以下「IC」という。) 手続が不要とされている( 指針 第8の1⑵ア (ア)②、同イ(ア))。
- 新 た に作成 する 仮名加工情報 を研究に用いる場合 、 個人情報を これから 加工すること となるため 、公衆衛生例外などの例外規定に該当しない限り IC を 取得す ることが必要である( 指針 第8の1⑵ア、同イ)。
|
≪論点≫
- 医療機関が保有する仮名加工情報を用いたAI医療機器の開発にかかる企業との共同研究に関する指針上のIC手続について、令和3年度厚生労働科学研究費補助金(政策科学総合研究事業 臨床研究等ICT基盤構築・人工知能実装研究事業)AIを活用した医療機器の開発・研究におけるデータ利用の実態把握と課題抽出に資する研究(21AC0701)研究班より、下記のとおり指摘がなされた(第5回合同会議参考資料2-1、参考資料2-2)。
- 生命・医学系指針第4章第8の 1(2) イ(試料を用いない研究) において、インフォームド・コンセントを受けない場合の要件として「 ア ) 当該研究に用いられる情報が仮名加工情報(既に作成されているものに限る。)、匿 名加工情報又は個人関連情報である場合」と規定されているが、この場合の 仮名加工情報が、「既に作成されているものに限る。」となっている点は、 仮名加工情報を利活用したいという医療機関や企業側から見れば実質的に生命・医学系 指針独自の上乗せ規定 のようにも見え 、企業が共同利用の枠組みで、仮名加工情報を AI 医療機器の開発に利活用する上で弊害とな りう る ことが懸念される 。
- 個人情報でない仮名加工情報 は、 作成を開始する時点においては個人情報であり、作成が完了した段階においては他の情報と照合しない限り特定の個人を識別できない情報であるため、 生命・医学系指針第4章第8の1 ( イ(試料を用いない研究) に つ いて、「既に作成されているものに限る」の要件が匿名加工情報には課されず、仮名加工情報(個人情報でない仮名加工情報)にのみ課されることは、整合性がとれていない のではないか 。
- 以上より、令和 2 年改正個人情報保護法では情報の利活用促進を目的として仮名加工情報が新設されたが、改正生命・医学系指針では「既に作成されているもの」に該当しない仮名加工情報の利活用について、実質的に上乗せ規定が設けられており、仮名加工情報の利活用を進める上で弊害となっているため、今後見直しなどが求められるのではないか。
|
- 個人情報でない仮名加工情報については、匿名加工情報とは加工の程度及び個情法上の取扱い(第三者提供の可否等)が異なることから、同様に考えるべきではないのではないか。
- また、新たに仮名加工情報を作成する場合、現行指針においては、公衆衛生例外などの個情法上の例外規定に該当しない限り、ICを取得しなければならないが、年数の経過した過去の患者からICを取得することは困難であるとの指摘がある。
- 仮名加工情報の利活用推進と研究対象者保護の観点からの見直しが必要ではないか。
|
| 第5回合同会議における意見 |
- 個情法上は同意不要とされているものについて、指針上、倫理審査だけではなく同意手続も必要とすることが妥当かについて検討が必要ではないか。併せて匿名加工情報の取扱いについても見直す必要があるのではないか。
- 匿名加工情報と仮名加工情報で、法律上の取扱い(第三者提供の可否等)が異なる点も考慮に入れるべきではないか。
- 「同意取得が困難な場合」という要件の解釈が曖昧であるため、明確にすべきではないか。
- そもそも仮名加工情報のIC手続について、「既に作成されていたか否か」で分けて規定する必要があるのか。
|
| 第6回TFにおける意見 |
【「既に作成されている」という限定の要否について】
- 研究において仮名加工情報が取り扱われる場合は極めて限定的であり、個情法により取扱いに係る義務(第三者提供や識別行為の禁止等)も規定されていることから、研究対象者の権利利益が不当に侵害されることは考えにくいため、「既に作成されている」という限定を外すことで良いのではないか。
- 仮名加工情報の取り扱いについては現場での理解が浸透しておらず不正確な理解も散見される。研究に用いる場合の具体的な取り扱いについては指針だけでなく個情法や個情法のガイドライン等を参照する必要があることを含め、法に基づく適切な利用を確保することが重要である。
- 仮名加工情報は識別行為が禁止されているため、既に作成されている場合にはオプトアウトはできないが、新たに作成する場合には加工前にオプトアウトが可能であるため、オプトアウトの機会を奪ってしまってよいかについては、慎重に検討すべきではないか。(事務局)
- 仮名加工情報は個人情報であるものとそうでないものがあり、診療情報を前提とすると医療機関はカルテの保存義務があるため、基本的には医療情報から作成するものは個人情報である仮名加工情報となる場合が多い。特に診療情報については要配慮個人情報に該当するため慎重な取扱いが必要ではないか。(事務局)
- ヘルシンキ宣言を踏まえ、被験者保護の観点からも拒否機会を保障するなど、なんらかの上乗せが必要ではないか。(事務局)
【同意取得困難要件の要否について】
- 個情法上、仮名加工情報の目的変更については同意不要とされていることや、識別行為が禁止されていることから、仮名加工情報を取り扱う場合の同意取得困難要件を外してはどうか。
|
| 第6回合同会議(書面協議)における意見 |
- 新たに作成する仮名加工情報については、容易に同意 を取得できる場合にまで同意不要とすべきではないことから、同意取得困難要件の解釈について明示した上で、同意取得困難要件を課すべきではないか。
|
【方向性】
- 仮名加工情報を研究に用いる場合については、当該情報が個人情報であるか否かにかかわらず、引き続き、既に仮名加工情報として作成されているものを用いる場合に限りIC手続を不要とすべき。 新たに作成する仮名加工情報を研究に用いる場合は、公衆衛生例外などの例外規定に該当しない場合であっても、オプトアウトも可とするべき。
- 仮名加工情報を取り扱う場合の同意取得困難要件については、個情法上、仮名加工情報の目的変更については同意不要とされていることから、引き続き、課さないこととすべき。
- 仮名加工情報を自機関利用する場合に同意取得困難要件がないことと均衡を図る観点から、匿名加工情報を自機関利用する場合についても、同意取得困難要件を外すべき。
|
(2)既存試料・情報を自機関利用、他機関提供する場合における社会的重要性の要否
<現行指針における取扱い>
- 試料を用いる研究 のために既存試料・情報を自機関利用する場合 であって、学術研究例外等の 個情法 上の例外規定に該当する場合 に、 適切な同意又はオプトアウトによる ことができるのは 、 「社会的に重要性の高い研究」に限定されている 指針 第8の1⑵ア (ウ))。
- 他方、 試料を用いない研究のために 、 既存の情報 (要配慮個人情報を含む。 を自機関利用する場合であって、学術研究例外等の 個情法 上の例外規定に該当する場合 に、適切 な同意又はオプトアウトによることができるのは、「社会的に重要性の高い研究」に限定されていない( 指針 第8の1⑵イ(ウ ))。
- また、他機関に 既存試料 や既存の要配慮個人情報 を 提 供 しようと する場合 であって、学術研究例外等の 個情法 上の例外規定に該当する場合 に、適切な同意又はオプトアウトによ って提供する ことができる 研究 は、「社会的に重要性の高い研究」に限定されていない(指針第8の1⑶ア(ウ))。
|
≪論点≫
- 試料を用いる研究のために既存試料・情報を自機関利用する場合について、「社会的に重要性の高い研究」という要件を外すべきか。
- 「社会的に重要性の高い研究」という要件を外した場合であっても、自機関内に限定した利用であること、倫理審査を受けること、適切な同意又はオプトアウトにより新たな利用目的等は本人に通知又は研究対象者等が容易に知りうる状態に置くことになるので、研究対象者の保護はなされているのではないか。
- 自機関利用する際の適切な同意又はオプトアウトによることができる要件として、「社会的に重要性の高い研究」という要件を残した場合に、他機関に提供する際の適切な同意又はオプトアウトによって提供することができる要件として、「社会的に重要性の高い研究」という要件を課すべきか。
- 他機関に既存試料を提供しようとする場合に、適切な同意又はオプトアウトによって提供することができる研究を「社会的に重要性の高い研究」に限定すべきか。
| 第5回合同会議における意見 |
- 「社会的に重要性の高い研究」という要件の解釈(公衆衛生例外との関係を含む。)が曖昧であるため、明確にすべきである。
- 「社会的に重要性の高い研究」という要件については、歴史的経緯及び学術例外との関係や、研究対象者の保護の観点等から、その要否について十分に検討すべきではないか。
|
| 第6回TFにおける意見 |
- 既存試料を自機関利用する場合における「社会的に重要性の高い研究」という要件を外す場合、当該要件については、医療機関であらかじめ必要以上に試料を採取するといったことを避けるため規定されたという経緯があるので、その点について、ガイダンスに記載するなど注意喚起が必要ではないか。
- 既存試料を自機関利用する場合における「社会的に重要性の高い研究」という要件を残した場合、既存試料を他機関提供する場合についても平仄を合わせ、「社会的に重要性の高い研究」という要件を課すべきではないか。
- この場合、「社会的に重要性の高い研究」という要件について他機関提供を想定した記載となっていることや、前回の改正で学術例外・公衆衛生例外の具体的な要件が入ったことから、かつてのゲノム指針の規定(下記第5―14のエ)を参考にするなど、「社会的に重要性の高い研究」の意義について検討する必要があるのではないか。
|
| 第6回合同会議(書面協議)における意見 |
【既存の要配慮個人情報を、適切な同意又はオプトアウトにより、他機関提供する場合における社会的重要性の要否について】
- 現行指針において、既存の試料と要配慮個人情報を他機関へ提供する場合のIC手続は同じにしているため、今回の見直しの方向性により、既存試料の自機関利用における「社会的に重要性の高い研究」の要件を既存試料の他機関提供の際も付けるのであれば、要配慮個人情報を他機関提供する場合において、適切な同意又はオプトアウトによることができるための要件として、「社会的重要性の高い研究」の要件を課すべきではないか。
【「社会的重要性」の名称及び解釈について】
- 「社会的に重要性の高い研究」という要件の名称は、公衆衛生の向上目的との混同を生むおそれがあることや、社会的に重要性の低い研究にも試料・情報が使われている実態があるといった誤認を生じさせる可能性もあることから、要件の名称を改めるべきではないか。
- 「社会的に重要性の高い研究」という要件の解釈について、公衆衛生の向上目的との関係性が不明確であることから、関係性について整理すべきではないか。
|
【方向性】
- これまで、「社会的に重要性の高い研究」という要件が課されていた経緯や、試料からは科学技術の発展により、予想していなかった情報についても取得されるおそれがあることから、オプトアウトによる既存試料の自機関利用・他機関提供については「社会的に重要性の高い研究」という要件を課すこととすべき。
- 一方で、既存の要配慮個人情報の他機関提供については、学術研究例外等の個情法上の例外規定については同意不要とされていることから、引き続き「社会的に重要性の高い研究」という要件を課さないこととすべき。なお、要配慮個人情報の提供に当たっては、研究対象者等のプライバシーに特に配慮することが必要な場合があり得る。このため、ICを取得することが困難な場合であっても、可能な限り適切な同意を取得し、又はオプトアウトによる場合でも手紙やメール等で研究対象者等に通知するなどの特段の配慮の必要性について、倫理審査委員会で十分な検討が必要である旨をガイダンスに記載すべき。
- 既存試料を自機関利用する場合における「社会的に重要性の高い研究」という要件は、学術例外と公衆衛生例外の両方に課せられているが、社会的に重要性の高い研究と公衆衛生の向上のために行われる研究との区別が明確ではないため、記載を適正化すべき。
- これに伴い、既存試料を適切な同意により自機関利用する場合の要件に、「社会的に重要性の高い研究」という要件は課さないこととし、インフォームド・コンセントを受ける手続を行うことが困難であることを加えるべき。
- なお、「社会的に重要性の高い研究」という要件については、その解釈が曖昧であり、かつ基本方針(第1①)に社会的及び学術的意義を有する研究を実施することが挙げられていることから、「当該既存試料を用いなければ研究の実施が困難である場合」といったより明確な要件に改めることとすべき。
|
(3)簡略化規定のあり方
| <現行指針における取扱い>
➢ 下記の場合に、 IC 手続の簡略化が認められている。
- 指針第8の1⑴イ(イ)②(ⅰ) :要配慮個人情報の新規取得
- 指針第8の1⑶ア(イ)・イ(イ)②:既存試料・情報の提供
- 指針第8の1⑸イ(ウ) :IC手続簡略化による提供を受ける場合
- 指針第8の1⑹ア(イ) :外国にある者への試料・情報の提供
➢ 要配慮個人情報の新規取得及び既存試料・情報の提供の場合には、拒否機会の保障が求められている。 |
≪論点≫
- 簡略化規定においても拒否機会が求められていることから、試料・情報を取得、提供する場面に応じて、オプトアウトと簡略化との関係を整理することとしてはどうか。
| 第5回合同会議における意見 |
- 簡略化は、研究結果にバイアスが生じる可能性がある研究だけではなく、悉皆性を求めるような研究も前提とされていたのではないか。
|
| 【方向性】
○ 現行の規定を以下の方向性で整理すべき。
① 指針第8の1⑴イ(イ)②(ⅰ) :要配慮個人情報の新規取得
⇒ 研究の目的等を事前に伝えることにより、研究結果にバイアスが生じる可能性がある等の研究である場合や、悉皆性を求めるような研究である場合には、引き続き簡略化可能とする。
② 指針第8の1⑶ア(イ)・イ(イ)②:既存試料・情報の提供
③ 指針第8の1⑸イ(ウ) :IC手続簡略化による提供を受ける場合
⇒ 既存の試料・情報を用いる研究である場合、研究の目的等を事前に伝えることによる研究結果への影響は想定しにくいため、オプトアウトに一本化する。
④ 指針第8の1⑹ア(イ) :外国にある者への試料・情報の提供
⇒ ①~③に準じることとする。 |
(4)オプトアウト(研究対象者等が容易に知りうる状態に置く)等のあり方
≪論点≫
- 取りまとめにおいて、下記のとおり、オプトアウトの考え方については引き続きの検討課題としていたが、下記の例示について見直す必要はないか。
〈令和3年10月26日付け令和2年・3年改正個人情報保護法を踏まえた生命・医学系指針の見直しについて
(取りまとめ)〉
また、オプトアウトの考え方として、ガイダンスにおいては「研究対象者等が容易に知りうる状態に置く必要がある」としており、ホームページのトップページから1回程度の操作で到達できる場所への掲載等を例示しているが、これで十分かについては引き続き検討していくこととする。
- 本件については、簡略化規定における広報のあり方についても同様に検討する必要はないか。
- さらに、個情法上のオプトアウトと同様に、研究対象者等に通知し、又は研究対象者等が容易に知り得る状態に置くべき事項(第8の6)として、研究(又は第三者提供)の開始予定日を追加すべきではないか(個情法ガイドライン(通則編)参照)。
- また、同意を受ける時点では特定されなかった研究を行う場合のオプトアウト(第8の7)において、新たな研究又は提供先の情報を研究対象者等に対して適切に伝える方策について、検討するべきではないか。
| 第5回合同会議における意見 |
- オプトアウトについては、国民に十分に認識されていないため、国として周知や仕組みづくりが必要ではないか。
- オプトアウトについては、疾患別、治療法別にまとめる等の情報展開が必要ではないか。
- オプトアウトの掲載場所に関するルールの策定やHP上での周知等のオプトアウトの適切な実施に向けた環境整備について、研究機関の長の責務として新たに位置づけるべきではないか。
|
| 第6回TFにおける意見 |
- 研究参加者は、参加した機関での掲載であればより容易に知り得る場所となる。このように、研究参加者からの距離を意識すべきであり、掲載場所に関するルールの策定やHP上での周知等の環境整備義務は、研究機関の長だけでなく、既存試料・情報の提供のみを行う機関の長を追加するべき。
- 研究開発の進展を考えたときに、同意取得が困難である場合を補完するオプトアウトの仕組みは重要な位置づけにあり、その適切な実施においては研究参加者の認知度を上げることが必要であることを研究機関がしっかりと意識するための仕組みが必要。
- 他の研究機関に既存試料・情報を提供する際に、学術例外の適用がある場合については、昨年度の見直しにおいて、オプトアウト手続が適正に行われることを条件に「IC手続が困難であること」の要件を課さないとされたが、オプトアウトのあり方について引き続き検討となったことから、指針の改正は見送られた。今回、オプトアウトの適正な実施を確保するための規定が指針に盛り込まれることから、IC手続が困難であること」という要件は外すべきではないか。
|
【方向性】
- 既存試料・情報である場合においては、事前に知らせる手段がないことも想定されるため、ガイダンスにおける引き続きの例示として「ホームページのトップページから1回程度の操作で到達できる場所への掲載等」を示すべき。
- オプトアウトの掲載場所に関するルールの策定やHP上での周知等のオプトアウトの適切な実施に向けた環境整備について、研究機関の長及び既存試料・情報の提供のみを行う機関の長の責務として、新たに位置づけるべき。
- 簡略化規定における広報のあり方についても上記と同様の考え方とすべき。
- 他の研究機関に既存試料・情報を提供しようとする場合であって、学術例外の適用がある場合の「IC手続が困難であること」という要件の取扱いについては、上記見直し後のオプトアウトの実施状況や研究対象者等・国民の理解と浸透状況を評価した上で判断すべき。
- 研究対象者等に通知し、又は研究対象者等が容易に知り得る状態に置くべき事項(第8の6)として、研究(又は第三者提供)の開始予定日を追加すべき。
- 第8の7の規定におけるオプトアウトが想定される場合(第7(1)研究計画書の記載事項㉔を記載する場合)には、同意取得時の説明事項(第8の5)に、新たな研究又は提供先の情報の確認方法(例えば、電子メールや文書による通知、ホームページのURL、電話番号等)を追加すべき。
|
(5)適切な同意
| <現行指針における取扱い>
➢ 「適切な同意」については、下記のとおり定義されている。
生命・医学系指針第2(23) 適切な同意
試料・情報の取得及び利用(提供を含む。)に関する研究対象者等の同意であって、研究対象者等がその同意について判断するために必要な事項が合理的かつ適切な方法によって明示された上でなされたものであり、試料・情報のうち個人情報等について、個人情報保護法における本人の同意をいう。
➢ 学術例外などの例外規定が適用され、オプトアウトが認められている場合においても、オプトアウトによらず、適切な同意を受ける場合に研究対象者等に明示すべき事項については、オプトアウトの際に研究対象者等に通知等を行うべき事項と平仄を合わせるため、 「研究対象者等に6①、②及び⑥から⑨までの事項を通知した上で」等と規定している(第8の1⑵ア(ウ)、イ(ウ)、⑶ア(ウ)) 。 |
≪論点≫
- 「適切な同意」の定義については、分かりづらいとの指摘があったことから、定義を見直す必要はないか。
- 個情法上の同意と指針上の同意の齟齬があり、個情法における「本人の同意」に該当しても、指針での適用が許容できない同意(黙示の同意等)があり、定義を見直す必要があるのではないか。
| 第5回合同会議における意見 |
- 「適切な同意」に関し、以下の点について、整理が必要ではないか。
- 「研究対象者等に6①、②及び⑥から⑨までの事項を通知した上で」と入っているものと入っていないもので運用がどのように異なるのか。
- 「研究対象者等に6①、②及び⑥から⑨までの事項を通知した上で」と入っていない場合、6①、②及び⑥から⑨までの事項についてはどのように取り扱われるのか。
|
【方向性】
- 「適切な同意」の定義を見直すべき(例:個情法上の同意を「満たす」とする)。
- 学術例外などの例外規定が適用され、オプトアウトが認められている場合においても、オプトアウトによらず適切な同意を受ける場合に研究対象者等に明示すべき事項については、引き続き「研究対象者等に6①、②及び⑥から⑨までの事項を通知した上で」等と規定すべき。
- 一方で、適切な同意を受ける場合に研究対象者等に明示すべき事項を定めていない場合については、研究内容によって明示すべき事項が異なるため、研究ごとに当該内容についても倫理審査委員会の審査を受ける必要があることをガイダンスにおいて解説すべき。
|
3.その他の論点
(1)外国の研究機関に提供のみする場合の取扱い
| <現行指針における取扱い>
➢ 日本国外において、 日本 の研究機関と共同研究の関係にない外国の研究機関が実施する研究は、この指針の対象外である。
➢ また 、上記の 日本国外 での 研究のために 国内から 試料・情報 の 提供 のみを行う 場合 における指針の適用関係について明確になっていない 。 |
≪論点≫
- 日本国外における研究が実施される場合、情報漏えいが発生した場合のリスクを懸念する声がある。
- 試料については個人情報保護法上、本人への情報提供等の義務が課されておらず、情報提供及び同意の取得なく日本国外での研究のために提供されることについて、研究対象者保護の観点からどう考えるか。
【方向性】
- 日本の研究機関との共同研究や日本の研究者等が参加していない日本国外における研究についても、日本国内から日本国外にある第三者に試料・情報を提供する場合は、この指針の対象であることを明確にすべき。
|
(2)外国の研究機関に提供する場合の留意点
| <現行指針における取扱い>
➢ 現行指針においては、旧ゲノム指針に記載されていた、 「 海外 の研究機関との共同研究を実施する場合の細則 」 (下記)のうち、1.(3)について規定されていない。
[参考]旧ゲノム指針 第2の6
<海外の研究機関との共同研究を実施する際の細則>
1.第2の6(2)ア(イ)に規定する事項は次に掲げるものとする。
(1)インフォームド・コンセントを得られること(※)
(2)提供者の個人情報の保護について適切な措置が講じられること
(3)研究計画の科学的・倫理的妥当性について、相手国により承認されること、又は相手国が定める法令、指針等に基づいて相手国の機関内の倫理審査委員会若しくはこれに準ずる組織により承認され、相手国の研究を行う機関の長により許可されること
2.(略)
※学術例外・公衆衛生例外等あり
➢ 現行指針においては、移転先国の名称等に関する情報提供については、適切な同意を受けようとする場合にのみ課されている。
[参考]生命・医学系指針 第8の1⑹イ
外国にある者に対し、試料・情報を提供する者は、アにより研究対象者等の適切な同意を受けようと
する場合には、あらかじめ、次に掲げる情報を当該研究対象者等に提供しなければならない。
①当該外国の名称
②適切かつ合理的な方法により得られた当該外国における個人情報の保護に関する制度に関する情報
③当該者が講ずる個人情報の保護のための措置に関する情報 |
≪論点≫
- 上記のとおり、日本国外における研究が実施される場合、情報漏えいが発生した場合のリスクを懸念する声があるため、日本の研究機関との共同研究でない場合も含めて、外国の研究機関に対して試料・情報を提供する際の留意点について追加で規定すべき点はないか。
- 研究対象者の権利利益の保護の観点から、適切な同意を取得する場合だけではなく、簡略化による場合(第8の1⑹ア(イ))やオプトアウトによる場合(第8の1⑹ア(ウ))であっても、移転先国の名称等に関する情報提供を行うべきではないか。
| 第5回合同会議における意見 |
- ゲノム指針の細則に記載されていた事項に関連する事項について、指針本文に規定すべきか、例示としてガイダンスに記載すべきか、十分に検討すべきではないか。
|
| 第6回TFにおける意見 |
- 外国にある第三者への個人データ提供時の情報提供等について、現行の規定では、ICを受ける際の説明事項の中に個情法が求めている手続が全て含まれているわけではないため、現場に混乱が生じており、整理が必要。
|
【方向性】
- 外国の研究機関に試料・情報を提供する場合の留意点については、下記の点を含め、ガイダンスにおいて例示を示すべき。
- 旧ゲノム指針に記載されていた「海外の研究機関との共同研究を実施する場合の細則」のうち、1.(3)に規定されていた事項
- 適切な同意を受けるに当たっては、日本国外の研究機関における試料の取扱いに関する情報についても研究対象者等に提供しなければならないこと
- 適切な同意を取得する場合だけではなく、簡略化による場合(第8の1⑹ア(イ))やオプトアウトによる場合(第8の1⑹ア(ウ))であっても、移転先国の名称等に関する情報提供を行うべき。
- 外国にある第三者への個人データ提供時の情報提供等について、第8の5(IC取得時の説明事項)及び第8の6(オプトアウト時の通知等事項)において追記すべき。
|
参照
人を対象とする生命科学・医学系研究に関する倫理指針の一部を改正する件(概要)

