Table of Contents
審議結果報告書
令和3 年6 月1 日
医薬• 生活衛生局医薬品審査管理課
[販売名]
ハイヤスタ錠10mg
[一般名]
ツシジノスタット
[申請者名]
Huya Japan 合同会社
[申請年月日]
令和2年9月30日
[審議結果]
令和3年5月28 日に開催された医薬品第二部会において、本品目を承認して差し支えないとされ、薬事・食品衛生審議会薬事分科会に報告することとされた。
本品目は生物由来製品及び特定生物由来製品のいずれにも該当せず、再審査期間は10年、原体及び製剤はいずれも劇薬に該当するとされた。
[承認条件]
- 医薬品リスク管理計画を策定の上、適切に実施すること。
- 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤使用患者の背景情報を把握するとともに、本剤の安全「生及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
別紙 審査報告(1) 令和3年3月23日
起原又は発見の経緯及び外国における使用状況に関する資料等
申請品目の概要
HDACは、ヒストンや転写因子等のタンパクのアセチル化されたリジン残基からアセチル基を取り除く反応(脱アセチル化)を触媒する酵素群である。これらの酵素群によるヒストンの脱アセチル化は、クロマチン構造を凝集させ、遺伝子の転写を抑制すると考えられている。
本薬は、中国 Shenzhen Chipscreen Biosciences社により創製されたHDAC阻害作用を有する低分子化合物である。本薬は、ヒストン等の脱アセチル化を阻害することで、細胞周期の停止及びアポトーシス誘導を引き起こし、腫瘍の増殖を抑制すると考えられている。
開発の経緯等
海外において、中国 Shenzhen Chipscreen Biosciences 社により進行固形癌患者及び再発又は難治性の悪性リンパ腫患者を対象とした第Ⅰ相試験(TG0702CDM試験)が20■■年■月から実施された。
なお、2021年2月時点において、本薬は1カ国で承認されている(PTCL及び乳癌に係る効能・効果にて1カ国(中国)で承認されている。)が、再発又は難治性のATLLに係る効能・効果にて本薬が承認されている国又は地域はない。
本邦においては、申請者により、再発又は難治性のNHL患者を対象とした第Ⅰ相試験(201試験)及び再発又は難治性のATLL患者を対象とした第Ⅱb相試験(210試験)が、それぞれ2014年6月及び2016年11月から実施された。
今般、210試験を主要な試験成績として、本薬の申請が行われた。
なお、本薬は、「再発又は難治性の成人T細胞白血病リンパ腫」を予定される効能・効果として、2020年8月に希少疾病用医薬品に指定されている(指定番号: (R2薬)第480号) 。
臨床的有効性及び臨床的安全性に関する賓料並びに機構における審査の概略
本薬の臨床的位置付け及び効能・効果について
国内外の診療ガイドライン及ぴ血液学の代表的な教科書(Wintrobe's Clinical Hematology, 14th Edition、 Williams Hematology, 9th Edition)における、再発又は難治性のATLLに対する本薬の記載はなかった。
申請者は、再発又は難治性のATLLに対する本薬の臨床的位置付け及び効能・効果について、以下のように説明している。
① 病型について:
ATLLは、急性型、リンパ腫型、慢性型及びくすぶり型の4種の臨床病型に分類される。このうち、急性型、リンパ腫型及び予後不良因子を有する慢性型はアグレッシブATLLとして分類される。アグレッシブATLL患者に対しては多剤併用化学療法が施行されるものの、OSの延長等を示す標準的治療は確立されておらず、当該患者の予後は不良である(造血器腫瘍診療ガイドライン2018年版補訂版(日本血液学会編)) 。以上のような状況において、再発又は難治性のアグレッシブATLL患者を対象とした210試験において、本薬の臨床的有用性が認められたこと(7.R.2及び7.R.3参照)から、本薬は当該患者に対する治療選択肢の一つとして位置付けられると考える。
また、210試験の組入れ対象とされなかった、くすぶり型及び予後不良因子のない慢性型の患者への本薬の投与について、(i)皮膚病変を有するくすぶり型は予後不良であることが報告されていること(Journal of Dermatology 2014;41 :26-8)、 (ii)210試験では皮廣病変を有するアグレッシブATLL患者5/8例(62.5%) に奏効が認められたこと等を考慮すると、当該患者に対しても本薬の有効性が期待できると考えることから、許容可能と考える。
② 前治療歴について:
210試験の対象患者はモガムリズマブによる治療歴を有する患者であり、当該患者において一定の奏効が認められたことから本薬の投与が推奨される。一方、モガムリズマブによる治療歴のない患者については、(i)投与経験は限られているものの、201試験の1/3例(33.3%)で奏効が認められたこと、(ii)当該患者数は極めて希少であり、かつ当該患者に対する治療選択肢は極めて限られていること等を考慮すると、当該患者への本薬の投与は許容可能と考える。
なお、難治性のATLLについて、201及び210試験において検討された症例は6例と限られており、奏効例は認められなかったものの、最良総合効果がSDであった患者(3例)では、腫瘍量の減少が認められた。難治性のATLL患者を対象として臨床試験が行われ、承認された薬剤はないこと、及び難治性のATLLでは特に予後が不良であることを考慮すると、難治性のATLLに対しても本薬の投与は許容可能と考える。
上記①及び②の検討等を踏まえ、効能・効果に関運する注意の項において、下記の旨を注意喚起した上で、本薬の申請効能・効果を「再発又は難治性の成人T細胞白血病リンパ腫」と設定した。なお、ATLLに対する他の抗悪性腫瘍剤との使い分けについて、モガムリズマブはCCR4陽性のATLL患者に対して、再発又は難治性のみならず未治療の患者に対しても投与可能(未治療の患者に対しては、他の抗悪性腫瘍剤との併用による。)であるが、再発又は難治性のATLLに対して本邦で承認されているモガムリズマプ及びレナリドミドと本薬の臨床的有用性を比較した臨床試験成績は得られていないことから明確に結論付けることは困難であるものの、それぞれの薬剤の有効性及び安全性、個々の患者の状態等を考應した上で、医療現場において適切に判断されるものと考える。
- 臨床試験に組み入れられた患者の病型及び予後不良因子の有無等について、「臨床成績」の項の内容を熟知し、本薬の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
機構が考察した内容は、以下のとおりである。
再発又は難治性のATLL患者のうち、210試験の対象とされなかったATLL患者における本薬の有効性及び安全性は不明であり、当該患者に対する本薬の投与は推奨されないと考える。しかしながら、上記の申請者の説明に加えて、下記の点等を考慮すると、本薬の効能・効果及び効能・効果に関連する注意の項を申請どおり設定することが適切であると判断した。
- 難治性のATLLに対しては、奏効例は認められなかったものの、上記の申請者の説明に加えて、ATLLに対する二次以降の治療は、前治療に対する反応の有無別に確立していないこと等を考慮すると、難治性のATLL に対して本薬の投与は許容されると考えること。
- 国内診療ガイドラインにおいて、末治療のくすぶり型又は予後不良因子のない慢性型のATLLに対する治療は無治療経過親察と記載されている一方で、急性転化した場合には、急性型、リンパ腫型は予後不良因子を有する慢性型と同様の治療が推奨されており、当該治療後に病勢進行した際にも急性型、リンパ腫型又は予後不良因子を有する慢性型と同様の治療が推奨されていること。
- 再発又は難治性のATLLに対して既承認のモガムリズマブ及びレナリドミドはいずれも当該患者に対してOSの延長を示しておらず、標準的な治療は確立されていないこと。
- 本薬は造血器悪性腫瘍の治療に対して十分な知識・経験を持つ医師により使用される薬剤であること。
用法・用量について
本薬の申請用法・用量は「通常、成人にはツシジノスタットとして1回40mgを1週間に2回食後に経口投与する。」と設定されていた。しかしながら、本薬の投与間隔について、臨床試験における設定(3~4日間間隔)を踏まえ、本承認申諸後に用法・用量が変更され、「通常、成人にはツシジノスタットとして1回40mgを1週問に2回、3~4日間隔で、食後に経口投与する。」と設定された。また、用法・用量に関連する注意の項において、副作用発現時の用量調節の目安が設定されていた。
機構は、「6.R.1 本薬の投与時期について」、「7.R.2 有効性について」及び「7.R.3 安全性について」の項、並びに以下に示す検討の結果、本薬の用法・用量及び用法・用量に関運する注意の項を、下記のように設定することが適切であると判断した。
く用法・用泣>
通常、成人にはツシジノスタットとして1日1回40mgを週2回、3又は4日間隔で食後に経口投与する。なお、患者の状態により適宜減量する。
く用法・用最に関連する注意>
- 他の抗悪性腫瘍剤との併用について、有効性及ぴ安全性は確立していない。
- 本薬の投与により副作用が発現した場合には、以下の基準を参考に、本薬を休薬、減量又は中止すること。
本薬の減量ステップ
| 開始用量 | 40mg |
| ステップ1(1段階減量) | 30mg |
| ステップ2(2段階減量) | 20mg |
| ステップ3 | 投与中止 |
副作用発現時の休薬、減量、中止の目安
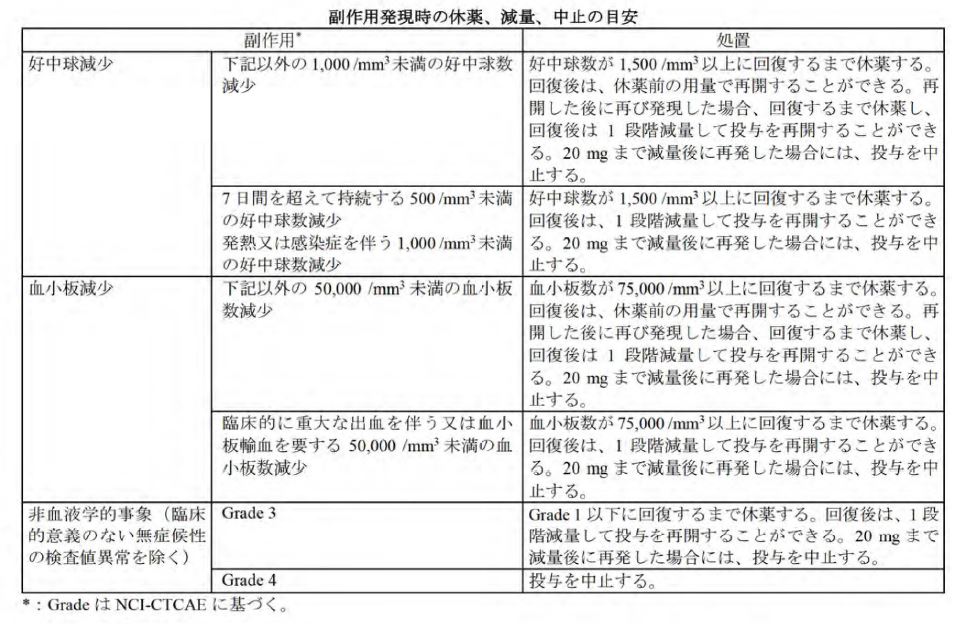
参照
PMDA医療用医薬品 情報検索
https://www.pmda.go.jp/PmdaSearch/iyakuSearch/
検索結果
| 一般名 | 販売名 | 製造販売業者等 | 添付文書 | 患者向医薬品ガイド/ ワクチン接種を受ける人 へのガイド |
インタビュー フォーム |
RMP | RMP資材 | 改訂指示反映履歴 および根拠症例 |
審査報告書/ 再審査報告書/ 最適使用推進 ガイドライン等 |
|
|---|---|---|---|---|---|---|---|---|---|---|
| 医療従事者向け | 患者向け | |||||||||
|
ハイヤスタ錠10mg
|
製造販売元/Huya Japan合同会社
販売元/Meiji Seika ファルマ株式会社
|
審査報告書
|
||||||||
